高速AFM
安藤敏夫
金沢大学特任教授 ナノ生命科学研究所(WPI-NanoLSI)主任研究員
ウェブサイト:http://biophys.w3.kanazawa-u.ac.jp/index_J.htm
安藤敏夫 教授のご略歴
高速AFMは液中環境の微小空間で起こる動的な現象の直接観察を初めて可能にした.バイオ分野では,生体分子(タンパク質やDNAなど)の機能中に起こる動的プロセスなどの観察に広く利用されている.未だ多くはないが,生細胞の形態変化や細胞表面で起こる動的プロセスの観察にも利用されている.マテリアルサイエンスの分野でも,合成高分子鎖[1],界面活性剤[2],ナノバブル[3]などで起こる動的プロセスや,固体表面の腐食[4],レジストの溶解[5],無機・有機物質の結晶化[6],電気化学反応[7]などの観察に利用されている.視覚化された動的現象は非常に直接的で分かり易く,説得力がある.また,動画映像には,既知の事実のみならず,全く新しい事実も現れるため,研究を加速する.ここでは,高速AFMを支える技術,観察例を概説する.詳しい技術,原理を知りたい読者は総説[8-10]を,観察内容とそこから導かれた事実の詳細については総説[11-13]を参照されたい.
AFMでは,探針と試料との接触の強さを一定に保つように,試料ステージをXY走査している間フィードバック制御を介してZ方向にも走査する(カンチレバー側を走査する方式もあるが,ここでは試料ステージ走査方式で考える).まずXY走査によって探針直下の試料の高さが変化し,それをカンチレバーが検出し,更にいくつかのデバイスでの入出力を経て,最終的に試料ステージがZ走査される.図1に,カンチレバーをその共振周波数でZ方向に振動させ,探針-試料間の接触の強さを振動振幅の変化として検出する所謂タッピングモードAFMでのフィードバックループを示す.それぞれのデバイスの応答には時間遅れがあるため,探針直下の試料の高さが変化してからZ方向のフィードバック走査が完了するまで時間がかかる.高速AFMではこの時間を短縮するために,各デバイスが高速応答するように工夫されている.また,試料ステージの高速走査時に振動が発生しないように工夫されている.
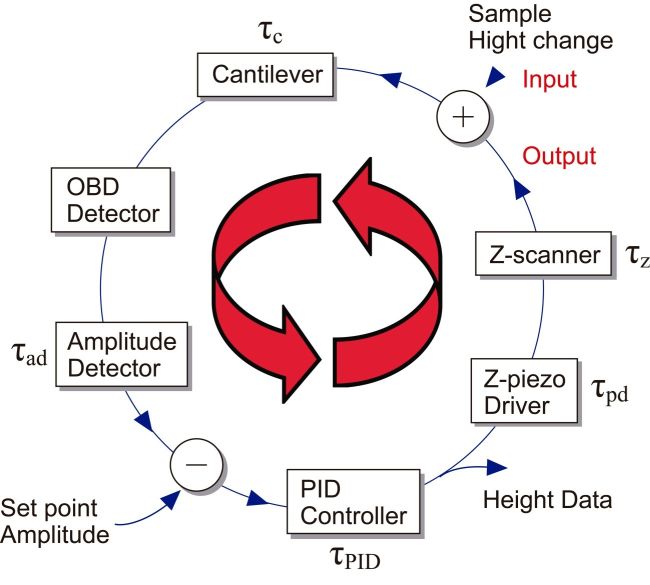
これらデバイスの中で,試料ステージを走査するZスキャナーとカンチレバーは力学的なデバイスであるため,エレクトロニクスデバイスに比べ,応答が遅い.カンチレバーの応答時間τcは,τc = Qc/(πfc)で表わされる.ここで,Qcは共振の鋭さを表わすQ値,fcは液中での第一次共振周波数である.τcを短くするには,共振周波数fcを大きくしなければならない.ばね定数を小さく保ち,fcを上げるには,小型軽量化するしかない.小型軽量化したカンチレバー(長さ約10 μm,幅2 μm,厚さ~100 nm)の水中でのQ値は1~2程度と小さい.バネ定数が0.1~0.2 N/m,水中共振周波数が400~800 kHzの微小カンチレバーが市販されている.我々は,水中共振周波数が1.2 MHzの特注品も利用している.Zスキャナーの応答速度もそこに利用されるピエゾ素子の共振周波数fpとQ値でほぼ決まる.Z走査範囲が約0.5~1 μmの場合,fp ≈ 200 kHz(ピエゾ素子を片端固定)が一般的である.ピエゾ素子のQ値は大きいため,Q値制御法[14]やノッチフィルターを利用して共振を防ぎ、応答速度を上げる工夫がされている.カンチレバーの振動振幅の計測を高速化する技術も開発され,振動周期の1/4[15], 1/2[16], 或いは,1/1[8]の時間で計測できる.
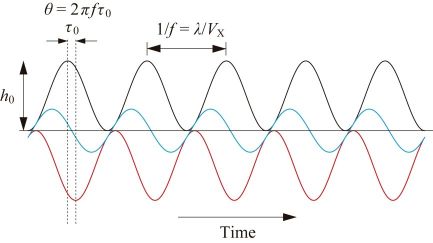
フィードバック走査を行っていないとき,探針直下にあるサイン波形状した試料の高さがX走査により時間とともに変化する様子を図2の黒線でに示す.フィードバック制御をかけると,この高さ変化に対してZスキャナーは逆向きに動くが,フィードバック制御の時間遅れ(τ0)のため,試料の凹凸変化の曲線より右にずれる(図2の赤線).黒線と赤線の和がフィードバックエラーである(図2の青線).エラーは,試料の昇り勾配の所でプラス,下り勾配でマイナスになる.つまり,昇り勾配では探針は目標の程度よりも試料を強く押し込み(カンチレバーの振幅値は目標値より小さくなる),下り勾配では押し込みが弱くなる(カンチレバーの振幅値は目標値よりも大きくなる).ところで,X走査を速くしていってエラーが大きくなると,下り勾配で探針は試料表面から完全に離れてしまう.一旦離れると,再着地までに時間がかかる.これをパラシューティングと呼ぶ.パラシューティングの間,イメージング不能となる.最初から探針を試料に強く押し込むようにしておけば(つまり,カンチレバーの目標振幅値を小さくしておけば)パラシューティングは防げる.だが,脆弱な試料は破壊されてしまう.パラシューティングは特に脆い試料系のイメージング速度を著しく律速するが,下り勾配でフィードバック走査を大きくするダイナミック制御法により解決された[17].どのくらいのエラーが許されるかであるが,それは試料の脆弱性に依存するものの,黒線と赤線のずれ(位相差θ)が45°(π/4)までとするのが一般的である.θ = π/4となるZ走査周波数をfBとすると,2πfBτ0 = π/4となるため,fB =1/(8τ0)となる.このfBをフィードバック帯域と呼ぶ.フィードバック帯域はカンチレバーも含めた高速AFM装置の速度性能を表わす最適なパラメータである.装置にも大きく依存するが,fc ≈ 500 kHzの場合fB = 30~40 kHz,fc ≈ 1.2 MHzの場合fB = 60~100 kHzが達成されている.走査範囲200 nm,走査線数100の場合,試料の高さがそれほど大きくなければ,DNAのように丈夫な分子では30 frame/s (fps)で,脆いタンパク質分子では,10 fps前後で高速AFMイメージング可能である.fBを更に上げる技術開発は現在でも進められており,近い将来,脆いタンパク質分子でも30~50 fpsでイメージング可能になると見込まれる.
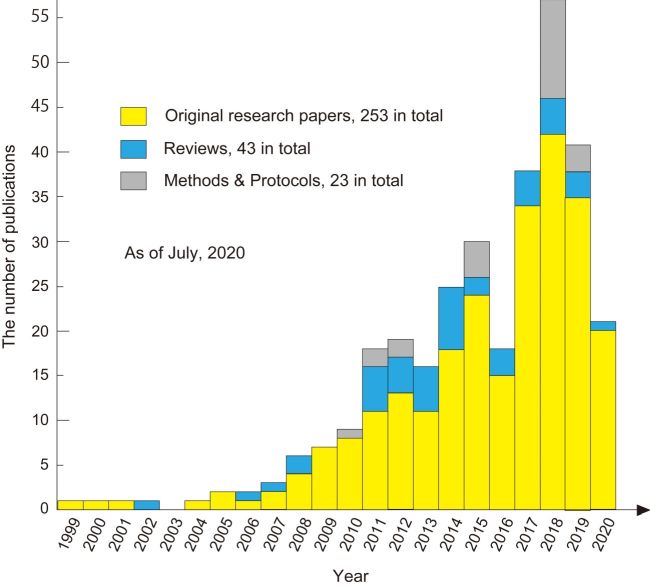
高速AFM観察研究の論文発表は最近急激に増加しており,バイオ分野に限ってもこれまでに250編以上の論文が発表されている(図3).高速AFM技術が確立した2008年以前でも高速AFMイメージングの成果が発表されているが,それらは高速AFM装置の性能評価や,可能性を探る研究である.様々な動的プロセスと試料系が高速AFMにより研究されているが,以下のように分類される.(i)機能中のタンパク質の構造変化,(ii)自己集合,(iii)構造揺らぎ,(iv)動的相互作用,(v)酵素反応,(vi)拡散運動,(vii)細胞形態変化と細胞表面で起こる動的現象,(viii)DNAオリガミなど生体分子で構成された人工構造体の変化,(ix)タンパク質などの高速な力学応答.これらの中で,自己集合に関する研究が最も多く,次に,機能中のタンパク質の構造変化に関する研究が多い.以下に我々の研究を二例示す.
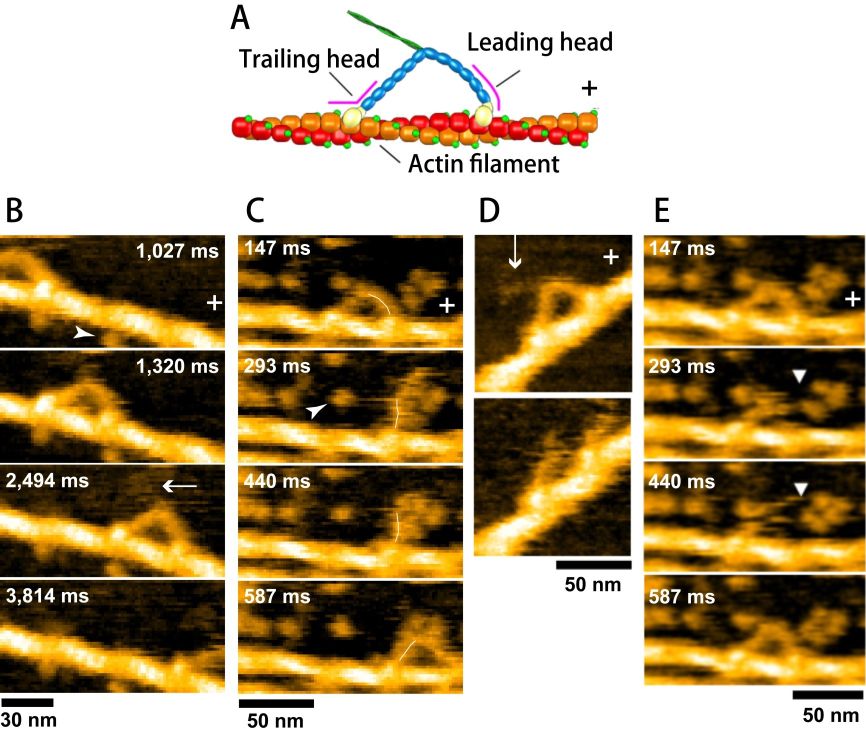
ミオシンV(M5):M5は細胞内の物質輸送を担うモータータンパク質のひとつである.アクチン線維に結合したあと1 分子で長距離運動する.この性質(プロセッシビティ)のお陰で1分子の長時間追跡が可能となり,光に基づく1 分子計測手法を用いて1999から10年間詳しく研究された.等価な二本の足が交互に前足と後ろ足になり,ATP分子の分解毎に約36 nm のステップでアクチン線維のプラス端に向かって歩行運動することが明らかにされた.また,かなり間接的な手法によってではあるが,ADP の解離速度定数とATPの結合速度定数が前足と後ろ足で異なることが示唆され,等価な二本足の前足・後ろ足の切り替え機構が提唱された.しかし,ATP分解で供給されるエネルギーがどのように前進運動の駆動力に変換されるのか,また,駆動力がどのように発生するのか,ATP分解反応のどの過程でエネルギー変換が起こるのかといった根本問題の解決には至らなかった.それゆえ,M5 は,高速AFMによる分子動態の直接観察によって既知の事実も含めどのようなことまで解明できるかを示す上で,絶好の試料であった.以下に述べるように予想外の発見があった[18].
長い尾部は歩行運動には関係しないため,そのほとんどを除去した試料を用いた.M5の歩行運動や他の振る舞いを観察するために,ビオチン脂質を含む脂質2 重層膜上に,ストレプトアビジンを介してビオチン化したアクチン線維を固定した.電気的に中性な脂質の極性基はタンパク質を吸着しないため,アクチン線維にM5が結合したときのみM5が観察された.しかしこの条件ではM5 は多くの場合アクチン線維の上部を動くためその特徴的な分子形態を捉えにくい.そこで,正電荷をもつ脂質DPTAP を若干加え,M5 が横向きで基板に載るようにした.図4B に示すように,前進運動しているM5分子を鮮明に捉えることができた.また,観察されたM5 の歩行速度は,蛍光顕微鏡観察で計測されたものとほぼ一致し,探針と試料の接触はモータ活性に影響しない.一歩進む過程は非常に速く,その途中の過程を捉えるには工夫が必要であった.前進運動を穏やかに阻害するために過剰のストレプトアビジンン分子を基板表面に撒いたところ,歩行中の過程を捉えることができた(図4C).後ろ足がアクチンから解離すると,ほぼ真っ直ぐな前足が後方に傾いた向きから前方に傾いた向きに自動的に回転する.この回転は,筋肉の研究でHugh Huxley によって提唱されていたLever Arm の回転運動 そのものであり,この仮説はここではじめて実証された.ヌクレオチド無しの条件でも,M5 は2 本足で同じアクチン線維に結合する.しかし,ヌクレオチドが存在する場合と異なり,前足は大きく屈曲した.したがって,前足の形態を観察すれば,前足にヌクレオチドが結合しているかどうか判断できる.そこで,前足が真っ直ぐな形態をとる寿命をADP 濃度の関数として計測し,前足でのADP の解離速度定数を見積もった.結果は0.1/s となった.すなわち,平均で10 秒間に1 回前足からADP が解離する.しかし,10 秒間にM5 は何歩も歩く. すなわち,歩行しているM5では前足からADP が解離することはなく,ADP の解離,それに続くATP の結合,その結果起こるアクチンからの解離は後ろ足でしか起こらない.これは,前足・後ろ足の交互の交換が起こる分子基盤である.
以上の観察結果だけならば,以前提唱された説の確証を得たに留まるが,高速AFMが捉えた分子映像には予想外の現象も現れた.まず,ADP存在下でアクチン線維に二足結合した分子の一部で,短いcoiled coilの尾部が解け,解けた直後に前足が前方に回転した(図4D).尾部の解け,それに続く前足の回転は,ATPのエネルギー供給なしに,分子内張力が発生し,その張力を利用して前足が回転し得ることを意味する.次に,ATP存在下でアクチン線維上に留まっている間,前足が時折アクチンから解離し直ぐに再結合する振舞い(足踏み:Foot Stomping と命名)が新たに見い出された(図4E).この再結合の直後に,前進運動する様子も観察された.M5頭部に結合したADP-PiからPiが解離する速度は非常に速いため,Foot stompした前足にはADPしか結合していない.それにも拘わらず,分子内張力が発生し,後ろ足にATPが結合しアクチンから解離すると,前足は自動的に前方に回転する.以上の予想外の観察結果は,前進運動のための分子内張力の発生には,そしてまた,前足の回転にはATP分解によるエネルギーは利用されていないことを物語る.つまり,ATPのエネルギーは,結合エネルギーとして後ろ足をアクチンから解離するために主に利用され,張力発生,前進運動という力学的仕事には変換されていない.また, ATPの加水分解で解放されるエネルギーは力学反応を一方向に効率よく進めるためにだけ利用されている.これは従来の常識を覆す全く予想外の発見であった.
F1-ATPase:ATP合成酵素の一部であるF1-ATPaseの主要部はα3β3のリングの中心孔にγサブユニットが挿入された構造をしている(図5A).ATP結合サイトは主にβサブユニットに局在する.光に基づく1分子計測により,F1-ATPaseは回転モーターであることが実証されている.α3β3リングは固定子として,γサブユニットは回転子として機能する.γサブユニットを上方から見たとき,γサブユニットは反時計回りに回転する.生化学的研究から,3つのβサブユニットは同じ化学状態を同時にとれないことが知られている.すなわち,ATP, ADP, ヌクレオチド無し(Empty)の異なる状態をそれぞれとる.ATPを結合したβサブユニットでATPが分解されADPになると,他のβサブユニットはEmptyからATP結合状態に,ADP結合からEmptyの状態に移行する.この反時計回りの化学状態の移行により,γサブユニットが回転すると考えられる.だが,βサブユニット間にはαサブユニットが存在するため直接的接触がなく,3つのβサブユニットがどのようにして互いに情報を交換して,異なる化学状態をとり得るのか不思議である.この謎に対して,γサブユニットが3つのβサブユニットの状態を支配するというモデル(γ支配説)が提唱された[19].γサブユニットには対称構造が存在せず,それ故,3つのγ-β相互作用は異なるため,γ支配説は非常に説得力がある.だが,それをどのように実証できるであろうか?γサブユニットを除くと回転が起こらないことを実証すればよいが,γサブユニットに蛍光プローブを導入する1分子計測法では,γサブユニット無しでは回転の有無を判断できない.以下の高速AFM観察研究はこの謎を解くだけでなく,意外な発見に導いた[20].
アミノシランコートしたマイカ表面をグルタルアルデヒド処理してアミノ基反応性とし,そこにβサブユニットのN端にLys7タグを導入したα3β3を結合させた.この配置では,C端側にある空いた中心孔は基板とは反対側に位置する.ヌクレオチド非存在下で観察したα3β3と,結晶構造から構築した擬似AFM像との比較から,中心付近の周りに見える3つZ方向の突起はβサブユニットのものであることが判明した(図5B).次に,非分解性ATPアナログであるAMP-PNP存在下で撮ったAFM像はひとつだけZ方向の突起を示した.同様にヌクレオチド存在下での結晶構造との比較から,この突起はEmpty状態のβサブユニットのものであることが判明した(図5C).この事実を利用して,ATP存在下で撮影した高速AFM像において,どのサブユニットがEmpty状態であるかを判断できる.次にATP存在下で高速AFM観察すると,突起をもったβサブユニットの位置が反時計回りに移動する様子が観察された(図5D).すなわち,Empty状態のβサブユニットの位置が反時計回りに回転し,化学状態が3つのβサブユニットに亘り反時計回りに伝搬することが見出され,γサブユニットなしにβ-β間の連携により化学状態の回転移動が起こることが実証された.この発見は,γサブユニットはα3β3から受動的にトルクを受けて回転しているだけであり、γサブユニットとは全く異なるタンパク質分子,或いは,DNA構造体をα3β3の中心孔に挿入すると,それらは回転することを予言する.この予言は後の研究により実証された[21].

スペースの都合上,多くの高速AFM観察研究を紹介できなかったが,上記二つの研究成果により高速AFMの威力を実感して頂けたであろう.未だ未だ高速AFM観察を待っている試料系は多く,これら試料系の観察でも必ず予想外の新発見があるであろう.高速AFMの開発者として,多くの研究者が高速AFMを利用し,素晴らしい成果を上げられることを期待している.
高速AFMを使ったバイオ研究に関する論文リストはこちらをクリックしてください。
安藤敏夫(金沢大学ナノ生命科学研究所)
